camara de neubauer
SangreRecuento de eritrocitos
Recuento de eritrocitos: ejemplo
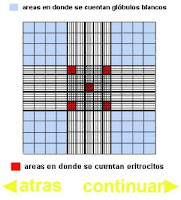
Observe que en la grilla de la cámara de Neubauer las áreas de recuento de eritrocitos y linfocitos son diferentes. Los glóbulos rojos se cuentan en las áreas coloreadas de rojo, mientras que los glóbulos blancos se cuentan en las áreas coloreadas de azul. Ten en cuenta que la grilla central tiene 25 cuadrados de 1mm x 1mm de área y 0.10 mm de profundidad. El factor de dilución es por tanto de 1:200. Convierte el número de glóbulos rojos contados en 5 cuadrados a nº glóbulos rojos/µl. (1 µl (microlitro) = 1 mm3
Como se hace?
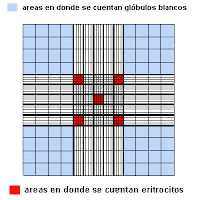
La imagen de abajo simula el campo que esta viendo al microscopio con un objetivo de 45x. Solo es visible el centro de la grilla. Intenta verificar esto al ir moviendo el campo de derecha-izquierda y de arriba-abajo, como si de una pletina de microscopio se tratase. Cuenta los glóbulos rojos en los cinco cuadrados mencionados anteriormente y determina el recuento de eritrocitos como se ha descrito anteriormente..
Muy importante: Cuando un eritrocito se sitúa en mitad de las líneas superior y/o de la izquierda, entonces es contabilizado. Pero no se contabiliza cuando se sitúa en mitad de las líneas inferior y/o de la derecha..
El rango normal de recuento de glóbulos rojos es el siguiente:
mujeres:
3.9-5.6 millones/µl
Hombres:
4.5-6.5 millones/µl
Determine el recuento del sujeto cuya muestra aparece en la imagen.
Cual es la solución?
TÉCNICAS DE CONTAJE CELULA
 R
RUna suspensión celular se caracteriza por presentar un número de partículas microscópicas dispersas en un fluido. Habitualmente será necesario determinar tanto la densidad de las células en la suspensión como el porcentaje de éstas que son viables.
Para determinar la densidad de las células se emplean diferentes técnicas, desde la relativamente simple cámara de contaje celular de la que existen numerosas variantes, entre ellas la que empleamos (cámara de Neubauer), hasta equipos automáticos de contaje celular como el "Cell Coulter" de la empresa Beckman-Coulter.
El principio del contador celular se basa en la medida de los cambios en la resistencia eléctrica que se producen cuando una partícula no conductora en suspensión en un electrolito atraviesa un pequeño orificio. Como se puede ver en el esquema, una pequeña abertura entre los electrodos es la zona sensible a través de la que pasan las partículas que se encuentran en suspensión. Cuando una partícula atraviesa el orificio desplaza su propio volumen de electrolito. El volumen desplazado es medido como un pulso de voltaje. La altura de cada pulso es proporcional al volumen de la partícula. controlando la cantidad de la suspensión que circula a través del orificio es posible contar y medir el tamaño de las partículas. Es posible contar y medir varios miles de partículas por segundo, independientemente de su forma, color y densidad.
En la unidad de Citometría de flujo y Microscopia Confocal de los Servicios Científico-Técnicos de la Universidad de Barcelona se dispone de contadores celulares.
Sin embargo, es posible determinar la densidad celular empleando métodos más sencillos. Nos basta con una cámara de contaje celular, por ej. la cámara de Neubauer, y un microscopio. Una cámara de contaje celular es un dispositivo en el que se coloca una muestra de la suspensión a medir. El dispositivo presenta unas señales que determinan un volumen conocido (x microlitros). Al contar bajo el microscopio el número de partículas presentes en ese volumen se puede determinar la densidad de partículas en la suspensión de origen.
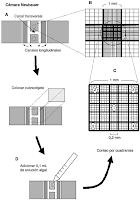
La cámara de Neubauer es una cámara de contaje adaptada al microscopio de campo claro o al de contraste de fases. Se trata de un portaobjetos con una depresión en el centro, en el fondo de la cual se ha marcado con la ayuda de un diamante una cuadrícula como la que se ve en la imagen. Es un cuadrado de 3 x 3 mm, con una separación entre dos lineas consecutivas de 0.25 mm. Así pues el área sombreada y marcada L corresponde a 1 milimetro cuadrado. La depresión central del cubreobjetos está hundida 0.1 mm respecto a la superficie, de forma que cuando se cubre con un cubreobjetos éste dista de la superficie marcada 0.1 milímetro, y el volumen comprendido entre la superficie L y el cubreobjetos es de 0.1 milímetro cúbico, es decir 0.1 microlitro.

La cámara de Neubauer es una cámara de contaje adaptada al microscopio de campo claro o al de contraste de fases. Se trata de un portaobjetos con una depresión en el centro, en el fondo de la cual se ha marcado con la ayuda de un diamante una cuadrícula como la que se ve en la imagen. Es un cuadrado de 3 x 3 mm, con una separación entre dos lineas consecutivas de 0.25 mm. Así pues el área sombreada y marcada L corresponde a 1 milimetro cuadrado. La depresión central del cubreobjetos está hundida 0.1 mm respecto a la superficie, de forma que cuando se cubre con un cubreobjetos éste dista de la superficie marcada 0.1 milímetro, y el volumen comprendido entre la superficie L y el cubreobjetos es de 0.1 milímetro cúbico, es decir 0.1 microlitro.
Si contamos las cuatro áreas sombreada (L) observando un total de x células entre las cuatro áreas, la concentración en la suspensión celular será :
concentración en la suspensión (células / mL) = 10000 (x/4

En la imagen puedes observar el aspecto de una de las regiones marcadas como L y que en el microscopio se ven como una cuadrícula de 16 pequeños cuadrados de 0.25 milímetros de lado. Esta imagen ha sido tomada empleando un microscopio invertido de contraste de fases.

Existen numerosos modelos de cámaras de contaje celular adaptadas a su uso en microscopía. En la imagen puedes observar una cámara de Neubauer doble, como las que usas en el laboratorio de prácticas.
Para determinar la viabilidad celular se emplean diferentes métodos. El más común es el de tinción con azul tripán. El azul tripán es un coloide que se introduce en el interior de las células que presentan roturas en la membrana. Así pues las células que aparecen en la imagen, claramente de color azul, son consideradas no viables. Asimilar células blancas, por exclusión, a células viables es un error pues por este método se sobrevalora la viabilidad de las células en la suspensión, determinando como inviables sólo aquellas con la membrana rota. Existen otros métodos de determinación de la viabilidad celular como el más preciso de la tinción con ioduro de propidio
En la red dispones de descripciones detalladas sobre como utilizar un hemocitómetro, como la propuesta por P.J. Hansen, o la detallada descripción que aporta Beckton-Dickinson, y los problemas de cálculo de parámetros celulares que plantea empleando datos obtenidos a partir de un hemocitómetro, y otros protocolos para el contaje de células (en protocol-online)
 Se aseptiza el dedo con alcohol y luego se seca al aire o con algodón. Se coge entre el pulgar y el índice y se hace una punción rápida y penetrante a través de la piel de la punta del dedo con una lanceta estéril.
Se aseptiza el dedo con alcohol y luego se seca al aire o con algodón. Se coge entre el pulgar y el índice y se hace una punción rápida y penetrante a través de la piel de la punta del dedo con una lanceta estéril.
2. Se deshecha la primera gota de sangre y se aspira la siguiente con la pipeta de dilución perfectamente limpia y seca hasta la señal 1 o 0.5 (también puede utilizarse la pipeta de hemoglobina, de 20 microlitros). Hay que evitar la entrada de burbujas de aire, pudiendo ayudarnos de un papel de filtro para conseguir el enrasado.
 3. A continuación se toma con la pipeta líquido de Hayem, isotónico con la sangre, hasta la señal 1; así, la sangre queda diluida al 1/10, si tomamos sangre hasta la señal 1, o al 1/20 si tomamos hasta 0.5. Esto es así porque el volumen de la bola de la pipeta es 100 veces superior al del capilar de la misma. (Si hemos utilizado la pipeta de hemoglobina podemos diluir su contenido en 2 o 4 ml de líquido de Hayem para obtener diluciones 1/100 o 1/200).
3. A continuación se toma con la pipeta líquido de Hayem, isotónico con la sangre, hasta la señal 1; así, la sangre queda diluida al 1/10, si tomamos sangre hasta la señal 1, o al 1/20 si tomamos hasta 0.5. Esto es así porque el volumen de la bola de la pipeta es 100 veces superior al del capilar de la misma. (Si hemos utilizado la pipeta de hemoglobina podemos diluir su contenido en 2 o 4 ml de líquido de Hayem para obtener diluciones 1/100 o 1/200).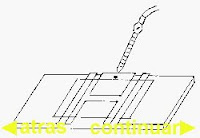
4. Tomamos la pipeta (o el tubo de ensayo) entre los dedos índice y pulgar y agitamos. A través de la goma de conexión con la pipeta, soplamos para despreciar las primeras gotas por corresponder al líquido que estaba en el capilar.
5. Se adapta un cubreobjetos sobre una cámara cuentaglóbulos limpia y seca y se coloca una gota en uno de los lados del cubre; esta gota penetra por capilaridad y rellena el retículo de la misma.
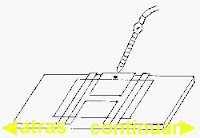
6. Una vez preparada la cámara se coloca sobre la platina del microscopio dejándose unos minutos en reposo para que sedimenten los glóbulos. Disponemos el condensador bajo y luz débil; enfocamos primero con el objetivo débil seco y luego se cambia al fuerte seco para proceder al recuento, que se lleva a cabo en los cuadrados pequeños del retículo marcado en color rojo. Finalizado el recuento se procede a la limpieza de la pipeta con acético 1:3, agua destilada y alcohol-éter sucesivamente.
7.El volumen de sangre en el cual se han contado las células resulta de multiplicar la profundidad de la cámara por el factor de dilución, la superficie de los cuadrados y el número de cuadrados contados.
Con cámara de NEUBAUER: Superficie de 1 cuadrado grande (1/20 mm de lado):
Volumen de un cuadrado grande (1/10 mm de profundidad):
Si contamos "a" glóbulos rojos en "n" cuadrados pequeños, el número de glóbulos por cuadrado será a/n.
Si en un volumen 1/4000 mm3 hay a/n glóbulos rojos, en 1 mm3 habrá X. Luego:
siendo X el número de glóbulos rojos existentes por cada mm3 de sangre diluida.
Si la sangre se diluyó a 1/100 o 1/200, habrá que multiplicar el valor X por 100 o 200 respectivamente, con lo cual obtendremos un nuevo valor, Y, que representa el número de glóbulos rojos existentes por cada mm3 de sangre (sin diluir).
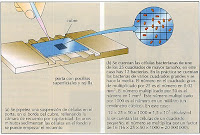
Se utilizan para calcular, mediante el uso del microscopio, el número de partículas (leucocitos, hematíes, bacterias…) por unidad de voluimen de un líquido.
La cámara está constituida por una placa base de vidrio especial pareciso a un porta, su parte central se encuentra separada de los extremos por unas ranuras. en ella se encuentran las cuadrículas de recuento.
La fórmula de contaje es: partículas/mm3= partículas contadas.
Clases de cámaras:
- Neubauer improved: Es el más utilizado (9 cuadros grandes, cada 1 de 1 mm2.)
- Neubauer: La diferencia es el cuadro grande central.
- Thoma: Se utiliza solo para el recuento de eritrocitos.
- Fuchs-Rosenthal: Se utiliza habitualmente para recuento de células en líquidos orgánicos (LCR, Líquido sinovial…)